Entretien avec Roberto Magnatantini, gérant senior de fonds actions et Iana Perova, analyste actions
- Une révolution médicale en marche : découvrez comment la médecine de précision transforme les traitements classiques en thérapies sur mesure en fonction de la génétique du patient.
- Des résultats personnalisés : entrez dans un monde où les résultats individuels en matière de santé surpassent l’approche traditionnelle uniforme.
- Relever les défis sociétaux : comprenez comment cette avancée peut atténuer les problèmes posés par le vieillissement démographique en proposant des solutions durables.
- Des opportunités d’investissement prometteuses : découvrez le potentiel d’investissement à long terme offert par le secteur en plein essor de la médecine de précision.
Nous avons inauguré cette année notre nouvelle série sur le bien-être, dans laquelle nous braquons les projecteurs sur les tendances les plus captivantes en matière de santé, en vous donnant un aperçu des évolutions les plus récentes et les plus intrigantes dans le domaine du bien-être.
Ce qui relevait autrefois de la science-fiction commence à devenir réalité : des traitements médicaux adaptés aux caractéristiques physiologiques (génétiques notamment) du patient, plutôt que des prescriptions standards. Cela permet non seulement d’obtenir de meilleurs résultats au niveau individuel, mais aussi d’aider à relever quelques-uns des défis sociétaux posés par le vieillissement démographique. Cela crée également des opportunités d’investissement prometteuses à long terme…
Iana et Roberto, pourriez-vous commencer par expliquer ce que signifie la « médecine de précision » et en quoi elle diffère de l’approche traditionnelle encore largement utilisée par les médecins du monde entier ?
La médecine à l’ancienne, telle qu’elle est encore largement pratiquée, n’entre en jeu que lorsque l’on est confronté à un problème de santé. Elle fonctionne ensuite sur la base de moyennes : les symptômes d’un patient sont attribués à la maladie qui en est habituellement à l’origine et ce diagnostic conduit ensuite à un traitement utilisant les médicaments qui fonctionnent le mieux pour l’individu moyen. Si ce traitement ne produit pas d’amélioration, un autre médicament sera prescrit ou le diagnostic initial pourrait être remis en question. En réalité, on procède par tâtonnement.
En revanche, la médecine de précision, également appelée médecine personnalisée ou individualisée, peut intervenir avant même qu’un patient ne se sente malade. Elle permet un diagnostic plus précoce et plus précis de la maladie et reconnaît dès le départ qu’il n’existe pas une seule solution pour traiter cette maladie.
Pourcentage de la population de patients pour laquelle un médicament donné d’une catégorie est inefficace, en moyenne.
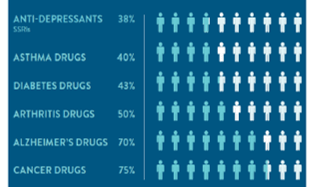
Reproduit avec la permission de : Spear,BB, Health-Chiazzi, M, Huff, J. Clinical application of pharmacogenetics. Trneds in Molecular Medicine, 2001;7(5):201-204.
Source : Raymond James Research
Les médicaments qui donnent de bons résultats pour certains patients peuvent être totalement inefficaces, voire provoquer des effets secondaires indésirables, chez d’autres patients.
Une meilleure compréhension de cette hétérogénéité humaine permet aux médecins de suivre une approche beaucoup plus ciblée consistant à faire en sorte que le patient bénéficie du traitement le mieux adapté à sa maladie. Dans certains cas, on procède même à des interventions médicales pour modifier le patrimoine génétique du patient afin d’améliorer l’efficacité du traitement.
Qu’est-ce qui favorise le développement de cette médecine de précision, qui met l’accent sur un patient précis plutôt que sur le patient moyen ?
Les progrès significatifs de la recherche en génomique ces dix dernières années, notamment en ce qui concerne les technologies de séquençage génétique et de profilage génomique, ont incontestablement favorisé l’avènement de la médecine de précision. La forte baisse du coût du séquençage – et du temps nécessaire à sa réalisation – y contribuent également. En effet, si l’environnement et le mode de vie d’un patient expliquent en partie sa réponse à un traitement, les spécificités génétiques individuelles joueront un rôle potentiellement déterminant.
Dans le secteur des sciences de la vie, des acteurs de premier plan tels que Thermo Fisher Scientific ou des entreprises plus spécialisées comme Tecan sont des fournisseurs clés pour un large éventail de solutions de séquençage du génome, depuis les kits de préparation de bibliothèques d’ADN jusqu’aux réactifs de séquençage en passant par les logiciels de bioinformatique. Leurs offres complètes simplifient l’ensemble du processus de séquençage, améliorant ainsi l’accessibilité et l’efficacité pour les chercheurs.
Parlons maintenant de la première étape de la médecine de précision : le dépistage. Comment les outils de la médecine de précision permettent-ils de dépister et d’établir un diagnostic précis pour un patient ? Et quelle est l’ampleur du marché potentiel pour les entreprises actives dans ce domaine ?
L’opportunité est considérable ! Selon un rapport de Fortune Business Insights, le marché mondial du diagnostic de précision devrait plus que doubler entre 2021 (60 milliards USD) et 2028 (139 milliards USD). La disponibilité de nouveaux outils, notamment le séquençage du génome entier (c’est-à-dire la détermination à un moment donné de la séquence complète d’ADN du génome d’un organisme), sera un levier essentiel de cette croissance. Mais d’autres facteurs entrent également en jeu : les efforts de réduction des dépenses de santé en parvenant un diagnostic le plus tôt possible, la limitation du nombre d’erreurs de diagnostic, l’amélioration de l’information des patients.
Du point de vue des catégories de maladies, une grande partie de la croissance – à court terme du moins – concernera l’oncologie. En effet, le cancer est actuellement l’une des principales causes de décès et l’Organisation mondiale de la santé estime que le nombre de nouveaux cas passera de 20 millions dans le monde en 2022 à 32,6 millions en 2045, en phase avec le vieillissement démographique.
Dans le diagnostic du cancer, les outils de la médecine de précision permettent d’analyser les mutations génétiques des cellules tumorales d’un patient, cruciales pour sélectionner les thérapies ciblées susceptibles de produire les meilleurs résultats.
Par exemple, le test sanguin FoundationOne de Roche identifie les altérations génomiques dans plus de 300 gènes liés au cancer.
En substance, en analysant les marqueurs moléculaires/mutations génétiques, les médecins seront sans doute mieux armés pour diagnostiquer avec précision les maladies, prédire leur évolution et déterminer les stratégies de traitement les plus efficaces, adaptées à chaque patient. Cela permet potentiellement d’économiser de l’argent et de nombreuses vies.
Des perspectives passionnantes, en effet ! Qu’en est-il de la phase thérapeutique, après l’établissement d’un diagnostic précis ? Pourriez-vous nous éclairer sur la façon dont la médecine de précision est en train de révolutionner les pratiques dans ce domaine ?
Tel que mentionné au début de cet entretien, après avoir évalué l’état de leur patient, les médecins commencent généralement par prescrire le traitement standard de première intention disponible pour cette maladie, même s’il est connu pour être inefficace pour de nombreux patients, si ce n’est la majorité d’entre eux. En effet, certaines études évaluent le ratio d’inefficacité à 38 % pour les antidépresseurs, 50 % pour les médicaments contre l’arthrite et même 75 % pour les médicaments contre le cancer.
Dans l’ère moderne de la médecine de précision, les médecins pourront s’appuyer sur des tests pharmacogénomiques, qui analysent le patrimoine génétique d’un individu pour prédire comment ce dernier réagira à certains médicaments, afin de prescrire immédiatement le médicament le plus adapté à leur patient. En général, c’est aussi celui qui engendrera le moins d’effets secondaires. On peut ainsi gagner un temps précieux.
La thérapie cellulaire, qui consiste à modifier les gènes des cellules d’un patient (ou d’un donneur) pour cibler des antigènes tumoraux spécifiques (c’est-à-dire des marqueurs) permet de franchir un palier supplémentaire. C’est déjà une réalité pour certaines formes de cancers du sang et le champ d’application devrait même s’étendre à d’autres domaines que l’oncologie, tels que les maladies auto-immunes et les fibroses. Il est intéressant de noter que des études sont également en cours pour déterminer comment les vaccins à ARNm (rendus célèbres par la pandémie de Covid) peuvent être utilisés pour administrer des thérapies cellulaires.
Sans oublier le potentiel considérable des thérapies géniques pour traiter, voire guérir, un certain nombre de maladies héréditaires dues à des mutations monogéniques. À ce jour, seules quelques thérapies de ce type, destinées à traiter des maladies extrêmement rares, ont été approuvées.
Néanmoins, les thérapies géniques sont prometteuses pour le traitement de maladies plus répandues comme l’hémophilie A.
Celles développées conjointement par Vertex et CRISPR utilisent la technologie CRISPR-Cas9 pour modifier l’ADN dans le corps humain, en ciblant la cause profonde des maladies au niveau moléculaire. Avec cette approche révolutionnaire qui permet de corriger les mutations génétiques à l’origine des maladies, l’objectif n’est plus simplement de traiter les symptômes mais de parvenir à une guérison permanente.
La collaboration entre ces sociétés a déjà abouti à des traitements prometteurs contre la drépanocytose et la bêta-thalassémie, deux maladies du sang héréditaires.
Comment s’effectue le suivi des patients dans le modèle de médecine de précision ?
Une fois que les patients commencent leur traitement, ils font l’objet d’une surveillance régulière à l’aide d’outils tels que des analyses de sang, l’imagerie et des dispositifs médicaux portables afin de suivre leur réponse physiologique et détecter tout effet indésirable à un stade précoce. Les données sont analysées pour évaluer l’efficacité et l’innocuité du traitement. Sur la base de cette analyse et des retours des patients, les prestataires de soins de santé ajustent les plans de traitement, en modifiant si besoin les dosages ou les médicaments pour optimiser les résultats et atténuer autant que possible les effets secondaires. Par exemple, les analyses de sang pour la maladie résiduelle minimale (MRM), qui détectent la présence d’un faible nombre de cellules cancéreuses dans le sang après le traitement, sont de plus en plus utilisées pour évaluer l’efficacité du traitement, prédire le risque de rechute, confirmer la rémission et détecter une éventuelle récidive.
Probabilité de réussite pour les nouveaux médicaments aux États-Unis avec ou sans biomarqueurs de sélection, par phase de développement entre 2011 et 2020
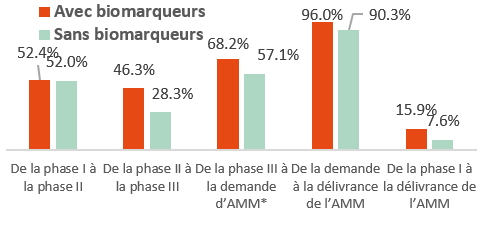
*AMM= autorisation de mise sur le marché
Source : Statista
Tout cela semble en effet très prometteur d’un point de vue scientifique. Mais l’adoption généralisée de la médecine de précision nécessitera, comme pour tout changement de paradigme, certains catalyseurs. Quels sont ces derniers ?
Vous avez raison. La vitesse à laquelle la médecine de précision prendra son envol dépendra des incitations à l’adoption, tant au niveau du prestataire de soins que du patient. En ce qui concerne les prestataires, la plupart sont toujours remboursés pour l’instant en fonction de la quantité de produits et de services délivrés. Rares sont les pays qui sont passés à un système de santé axé sur la notion de « valeur en santé », qui plaide clairement pour la médecine de précision.
En effet, lorsque les prestataires sont rémunérés en fonction des résultats obtenus pour les patients, ils sont incités à utiliser tous les outils et technologies disponibles afin que le traitement le plus efficace soit prescrit, et ce rapidement.
Les patients aussi ont besoin d’être (financièrement) convaincus des avantages qu’il y a à prendre soin de leur santé pour mieux vieillir. Cela suppose non seulement de s’engager dans la prévention, mais aussi d’accepter de se soumettre à des dépistages réguliers et de porter des appareils de surveillance médicale. Cela suppose également de consentir à ce que les données ainsi recueillies soient partagées tout au long de la chaîne de soins et d’être ouvert à de nouvelles formes de thérapie. Évidemment, cela pose un problème d’accessibilité financière (nécessité d’adapter les régimes publics et privés d’assurance maladie) mais c’est aussi une question de mentalité. Cela dit, lorsqu’un patient reconnaîtra qu’un traitement personnalisé fonctionne mieux et/ou comporte moins d’effets secondaires, il est fort possible que l’observance du traitement augmente et qu’un cercle vertueux s’enclenche.
En parlant de données patients, l’IA fait actuellement fureur sur les marchés financiers. Quel rôle l’analyse des données en général, et l’IA en particulier, sont-elles appelées à jouer à l’ère de la médecine de précision ?
Les trois propriétés déterminantes du « big data » sont le volume, la variété et la vitesse (également connues sous le nom de « 3 V »). Cela vaut notamment pour les données de santé, avec une accumulation rapide de données patients parfois très complexes. Nous entendons par là les dossiers médicaux bien-sûr, mais aussi les informations en temps réel provenant des appareils portables.
Le déploiement complet de la médecine de précision suppose que toutes ces données circulent de manière transparente et que les outils informatiques permettent leur analyse. À cet égard, l’IA jouera certainement un rôle clé.
Une entreprise comme GlobalData, par exemple, fournit de vastes jeux de données relatives aux essais cliniques, y compris aux protocoles d’essai, à la démographie des patients et aux résultats des traitements. Ces données aident les chercheurs à identifier les essais cliniques pertinents pour des populations de patients spécifiques et à optimiser la conception des essais pour les interventions de médecine de précision.
Vous avez décrit de manière convaincante les promesses de la médecine de précision, ainsi que les catalyseurs de son adoption. J’imagine qu’il existe un certain nombre d’obstacles qu’il convient de porter à la connaissance de nos lecteurs…
Comme pour tous les changements de paradigme, il y aura certainement des obstacles à surmonter. Dans le cas de la médecine de précision, il convient d’abord de mentionner un point auquel nous avons fait allusion plus tôt : l’acceptation par les patients. Convaincre les patients de communiquer leurs données privées et d’accepter de nouvelles méthodes de traitement pourrait en effet s’avérer compliqué.
Un autre obstacle potentiel est la nécessité pour les entreprises pharmaceutiques et biotechnologiques de concevoir des essais cliniques plus intelligents/complexes, avec une population cible plus restreinte. En effet, alors que les essais cliniques sont traditionnellement conçus pour déterminer comment parvenir au « meilleur résultat pour la plupart », les essais cliniques intelligents pour les thérapies ciblées sont en train de transformer la recherche médicale. Les laboratoires pharmaceutiques ont de plus en plus tendance à externaliser la gestion des essais à des organismes de recherche clinique (ORC) spécialisés tels qu’IQVIA et ICON plc, qui disposent d’un réel savoir-faire dans le recrutement des patients et la coordination des essais, deux aspects essentiels pour des essais rationalisés et efficaces.
La démonstration de l’efficacité d’un traitement est essentielle pour obtenir le feu vert des autorités réglementaires. Cela nécessite une conception précise des essais englobant la sélection des patients, la détermination de la posologie et la durée du traitement. La complexité des thérapies ciblées accentue l’importance d’une planification pertinente des essais, en particulier pour identifier et catégoriser les patients sur la base de biomarqueurs ou de la génétique. Outre le principe actif du traitement, une conception méticuleuse des essais est essentielle au succès du traitement et à l’obtention d’une AMM.
La couverture et le remboursement des thérapies de précision, très coûteuses, posent également problème. Les assureurs exigent des preuves d’efficacité, ce qui complique les choses lorsque les patients ont une couverture insuffisante. La collaboration entre les laboratoires et les payeurs dans le cadre de modèles de paiement axés sur les résultats pourrait favoriser l’adoption de la médecine de précision dans un contexte de transition vers un système de santé axé sur la notion de « valeur en santé ».
Pour conclure, pourriez-vous aborder le sujet primordial de la prévention et la manière dont la médecine de précision pourrait également la révolutionner ?
La prévention est essentielle pour remodeler le système de santé, comme en témoigne le cas du diabète de type 2. Il s’agit de la maladie chronique la plus coûteuse aux États-Unis avec 237 milliards USD de dépenses directes et 90 milliards USD de perte de productivité chaque année. Des études montrent que les changements de mode de vie et l’utilisation précoce de la metformine (le traitement standard de première intention) peuvent réduire son incidence de 58 % et 31 %*, respectivement. À l’ère de la médecine de précision, mieux cerner le profil des individus susceptibles de devenir diabétiques (en évaluant la prédisposition génétique à la maladie) afin d’administrer un traitement prophylactique peut permettre d’éviter que la maladie se déclare, contrairement aux traitements réactifs post-diagnostic. Le diagnostic de précision renforce encore les efforts de prévention en permettant le dépistage précoce des maladies, le suivi et les traitements personnalisés, ouvrant ainsi la voie à des outils de diagnostic innovants.
* Diabetes Prevention Program Research Group, New England Journal of Medecine 2002

Roberto Magnatantini, CFA, Gérant de portefeuille senior
Iana Perova, Analyste actions
À propos des stratégies de DECALIA exposées dans la thématique abordée :
- DECALIA Silver Generation est une stratégie thématique qui investit dans des entreprises qui bénéficieront structurellement de la tendance à la longévité. Cette stratégie vise à saisir des opportunités sur l’ensemble de la chaîne de valeur de la longévité : les acteurs de la consommation, les acteurs de l’espérance de vie et les entreprises de transformation.
- DECALIA Sustainable SOCIETY est une stratégie multithématique qui investit dans les 7 thèmes (Sécurité, O2 & Écologie, Cloud & Numérisation, Industrie 5,0, Seniors & Bien-être, Tech Med, Jeune Génération) qui façonneront la société de demain. Les thèmes Seniors & Bien-être et Tech Med représentent actuellement 22 % du fonds.
- Ces deux stratégies sont gérées par une équipe de gestion expérimentée.
À propos de DECALIA SA
Fondée à Genève en 2014, DECALIA se spécialise dans la gestion privée et la gestion d’actifs pour les particuliers et les institutionnels. Avec plus de 70 collaborateurs et 4,9 milliards de francs suisses d’actifs sous gestion, DECALIA s’est développée rapidement, grâce notamment à l’expérience de la gestion active, acquise par ses fondateurs au cours des 30 dernières années. Les stratégies développées par DECALIA s’articulent autour de quatre axes d’investissement porteurs dans une perspective à long terme : la désintermédiation du secteur bancaire, la quête de rendement, les tendances de long terme et les inefficiences de marché. DECALIA est réglementée par la FINMA et dispose d’une licence de gestionnaire de fortune collective. Outre son siège social à Genève, le groupe dispose de bureaux à Zurich et à Milan et de distributeurs de la Sicav DECALIA en Espagne et en Allemagne.
